生物标志物的概念早在1983年被首次提出,它是指可以标记系统、器官、组织、细胞及亚细胞结构或功能的改变的生化指标,具有非常广泛的用途。由于生物标志物可用于疾病诊断、判断疾病分期或用于评价新药或新疗法在目标人群中的安全性及有效性,展示出在药物研发领域的重要作用,2010年10月,美国FDA出台文件讨论生物标志物指导原则草案,预示着生物标志物已成为新药临床研究的评价工具之一(图1)。美国NIH给生物标志物以更实用的诠释:用以评价和衡量被试个体生物学过程,病理学过程以及对治疗干预药理学反应的特征指标。包括核酸,蛋白,代谢衍生物在内的诸多分子都可以成为潜在的生物标志物。蛋白是生物学功能的执行者,位于中心法则的功能一端,能够为基础医学、转化医学和精准医学提供最直接的判定依据,因而是研究和应用最为广泛的标志物。因而对蛋白标志物的检测技术也最为重要。迄今为止,抗体仍然是蛋白生物标志物检测最根本的基础,众多方法以抗体为核心建立,并且不断更新和发展,本综述拟从应用视角出发,较为系统地分析和比较现有蛋白生物标志物的检测技术,并结合全新技术的发展,对生物标志物的前景进行展望。


图2. 生物标志物在药物研发领域的应用
蛋白生物标志物可以帮助人们了解生物学过程,能运用于疾病的高危评估,早期诊断,检测定位,预后判断,治疗反应,复发监测全过程。在早期诊断方面,以肿瘤研究为例,生物标志物可以提供预测,诊断和预后信息。特别是近年来兴起的个性化治疗和差异化诊断技术方面,生物标志物发挥的作用也日渐重要。因此不论对于科学研究还是制药企业,生物标志物都是关注的焦点。生物标志物既可以为药物的作用机制,如何影响靶点,以及下游的效应提供关键的洞见(图2),也可在药物早期研究中鉴定药物或治疗手段的毒性和副作用(例如肝毒性,肾毒性,心脏毒性,肌肉毒性等等。)这对于药物研发有非常重要的意义,据统计,药物研发过程中止的最重要原因来自药物安全性评价或毒理学测试失败(图3,约占33%),而药效不足仅排在第二的位置(26%)。
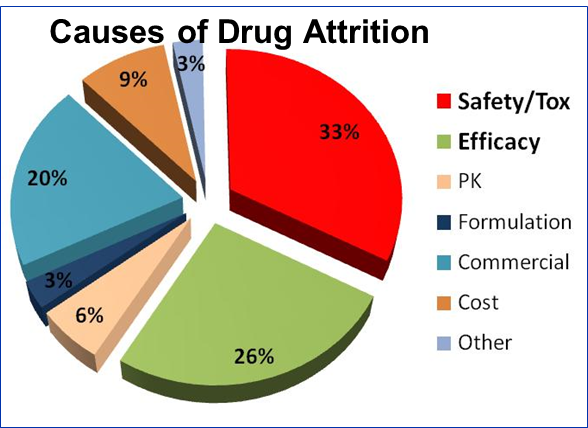
图3 药物研发失败原因分析
近年来兴起的全新治疗策略,例如嵌合抗原受体T细胞(即CAR-T)治疗急性淋巴细胞白血病也对生物标志物的应用有了新的启示。由于CAR-T细胞本身是具备免疫源性的物质,当输入患者体内时,在治疗效果之外,常会产生非常严重的副反应,例如细胞因子释放综合症(Cytokine Releasing Syndrome, CRS)。人们对于CRS的认识与一位叫做Emily Whitehead的明星患者有很重要的联系。Emily在治疗史上的重要地位在于,在她之前的数位治疗患者,出现过连续的病例死亡的情况,而她本身也发生了严重的炎症反应。幸运的是,治疗团队利用抗炎性药物帮助Emily挺过了让人绝望的高烧。最终Emily成功活了下来。至此,Michel Sadelain(CAR-T技术的命名人,现供职于JUNO公司)等先驱开始应用蛋白多因子检测技术对细胞因子生物标志物在治疗过程中进行监控,并发现治疗后关键的细胞因子CRP表达水平可以很好地判定CRS的风险(图4,参考文献2)。仅当CRP因子的表达量超过20mg/dl时,才会出现严重的细胞因子释放综合症。来自中国的成功CAR-T治疗案例里,蛋白多因子检测技术也被成功应用(数据未展示)。
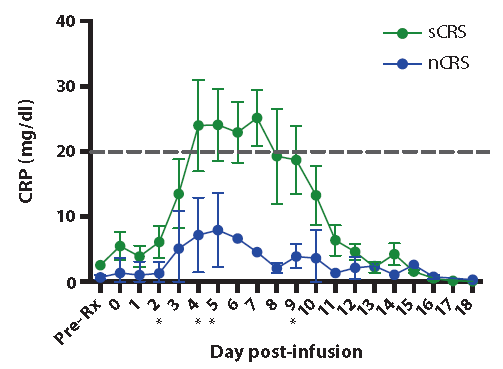
图4. CRP标志物监测细胞因子释放综合症
生物标志物检测的创始:免疫组织化学
人类最早是在组织样本中实现了生物标志物的检测。组织特异性的标志物在现代医疗中被经常用来研究肿瘤等疾病中的病理变化。最经典的被转化医学成功应用于组织中标志物检测的方法是免疫组织化学(Immunohistochemistry),特别是在肺炎中的早期应用。免疫组化技术在1940年代发明时(参考文献1),初衷是证实病原体的存在部位,例如肺炎球菌II型和III型多糖在鼠中的定位。过氧化物酶标记技术在1979年成熟,免疫组化的灵敏度被显著提高。带来的直接益处是福尔马林固定石蜡包埋(FFPE)组织切片的免疫组化检测。多数情况下免疫组化使用酶联抗体来进行显色反应,并通过显微镜镜检。尽管在医学检验中使用广泛,但这项技术仍然存在瓶颈:需要非常专业的操作人员和极为严格的标准,还仅能得到半定量的结果。近些年来专家致力于免疫组化的标准化和自动化。但要在全世界各地的实验室实现非常一致的免疫组化,并且在假阳性或假阴性等区分度方面达到一致的判别标准,还面临众多的困难,争论和挑战。人们对免疫组化应用于标志物检测的展望包括提高灵敏度以检测低丰度蛋白,较好的动态检测范围,更高的空间分辨率以判别标志物表达的细胞类型甚至是细胞器类型。另外,免疫组化在多重性,绝对定量以及特异性方面的需求还没有得到有效满足。
生物标志物的应用关键:体液样本检测
生物标志物近年来引起了极大的关注,因为有大量在血浆或血清中的蛋白标志物被鉴定。尽管这些蛋白有较高的转化医学价值,但现有技术的检测灵敏度或检测能力仍然是主要的制约因素。事实上在过去长达15年时间里,平均每年进入临床应用的新的生物标志物仅为1-2个。在平台的选择方面,灵敏度并不是唯一的考量,准确性,可重复性,动态检测范围大小以及样本通量决定标志物检测能力。由此也不难理解为什么质谱技术在体液样本检测中的应用不广:质谱最主要的缺陷是不适合复杂样品的分析,特别是体液样品,体液的样本除了成分复杂,更有巨大的动态范围。
在血清和血浆这样的生物样本中检测蛋白标志物,动态检测范围是区分度的关键。不仅个体间同一指标可以出现几十倍甚至上百倍的产别。同一份样本里的不同标志物更是可以达到10个数量级的差别。例如白蛋白含量大约在30-50mg/mL,而细胞因子可低至pg/mL. 而潜在的大量新型生物标志物甚至会远低于已知标志物的表达水平(新标志物常表达量较低,因而未被传统技术检出)。血清和血浆样本因其容易获得性,一直被当做最理想的生物标志物样本。但由于血液循环系统的稀释作用,血液样本中的蛋白标志物通常含量极低,需要高灵敏度的技术才能有效检测。
总体而言,对于体液样本的检测,人们需要较高的灵敏度来检测表达含量很低的样本。同时,尽可能拥有较宽的动力学范围来适应样本的浓度差异。尽管很多研究者可能认为现有传统技术已经可以很方便地测定一些常规的生物标志物,但事实上人们还是会经常发现有重要的标志物无法测得,并且根据数据结果较轻易相信样本中不存在目标分析物。在意识到现有技术其实不能充分检测样本中含量较低的分析物之前,重要生物学现象的发现机会就已经错失了。关于这一点在后文的篇幅中将做简明扼要的讨论。多重生物标志物检测(Multiplex)技术的兴起和发展使得研究者更容易利用有限的样本和经费做出科研发现,受到广泛的欢迎。但不论哪种平台,多重检测与生俱来的检测指标间相互干扰的问题很难避免,在涉及超高灵敏度检测需求时这种干扰经常大到无法被研究者忽视。这也解释更前沿、对数据要求更高的工作,例如药物研发,通常不把多重检测技术当成首选方案。
ELISA酶联免疫分析
ELISA(酶联免疫分析)是很早被应用于体液样本临床蛋白标志物检测的技术,因而也被当成“金标准”来使用,但事实上受制于较简单的实验范式和有限的优化措施,ELISA技术的灵敏度非常有限。而ELISA由于其使用抗体的不同,结果也会体现不同的检测效力。粗制多克隆抗体,亲和纯化的多克隆抗体,和单克隆抗体都在ELISA中有广泛的应用。在构建试剂盒时经常会需要对抗体的特异性,灵敏度等进行测试。应用不同的样本进行同一个抗体的Western Blot测试可以帮助我们判断抗体的特异性。对各种来源的抗体进行比较和优化,对于开发ELISA试剂盒,起到最为基础的作用。
Multiplex多重标志物检测技术
ELISA技术已经非常成熟且容易掌握,但其灵敏度和检测通量较低的问题吸引研究者的关注,并尝试开发更好的技术来替代这种传统方法。由于大量获取较廉价数据的需要,亦或是在样本量有限而需要获得较多数据时,多因子或多重分析物同时鉴定的技术对研究者意义重大。
代表性的多重生物标志物检测技术包括平面矩阵式检测和液相悬浮芯片。平面矩阵式检测以R&D等公司的固相蛋白芯片为代表,通过在固相芯片的不同位置免疫捕获不同的标准品或者样品,来利用空间位置实现不同样本的识别,而酶标二抗所产生的显色反应强弱报告了每个样本点的特定分析物含量,仪器通过简便的读卡就能判断不同分析物的含量。固相蛋白芯片分析重数较低以及动力学范围较窄的特性使得这项技术的应用受到一定限制,更适合于定性检测或者相对含量的判断。
液相悬浮芯片以Luminex平台为代表,BD等公司的CBA技术也可以归为此类。Luminex液相悬浮芯片采用的红色-红外双色/三色染料混合荧光编码,可以实现约100种/500种不同身份微球的识别。当把特定颜色的微球与检测特定指标的抗体偶联起来以后,不同微球就可以在同一份样本中独立工作,去分别捕获不同的标志物。该技术所使用的二抗仍然是标志物特异性的,上面带有生物素标记,可以同链霉亲和素-藻红蛋白显色剂结合。因此这项技术的研发关键也是要有针对同一抗原分子不同表位的抗体对。在检测结果时,与同一份样本孵育的不同微球会被两束独立工作的激光照射。红色激光用来识别微球的身份,从而告诉仪器正在检测的是哪种指标。另一束绿色激光激发藻红蛋白,从而依靠荧光产量判断分析物含量。CBA与Luminex有较为类似的编码方式,不同之处在于使用同一束激光来既判断微球身份,又判断分析物含量。在荧光补偿,仪器调整方面对操作者提出了更高要求。受制于物理特性,试剂盒检测分析物的重数也比较少,一般在10重左右。与此相对,得益于两束激光的协同工作,Luminex能把物理干扰减到更低的程度,理论上做到500重的同时检测都可实现。开发多重检测试剂盒的瓶颈不再是光学特性,而是不同抗体的交叉反应。尽管人们尝试各种办法尽量减低不同抗体对(antibody pair)的交叉反应,但在实际的试剂盒开发工作中,如果坚持对数据质量较高的要求,最高可接受的检测重数大约在40重左右。当液相悬浮芯片应用于核酸检测的时候,由于无需考虑抗体造成的交叉反应,检测重数可以大大增加。
液相悬浮芯片在实际的检测工作中具备明显而有力的价值。首先,液相悬浮芯片在取得接近于ELISA灵敏度的同时,有较大的检测范围(实际在3.0-4.5之间),具备较好的检测效力。其次,在低至25微升样本中可实现多达40重不同指标,能解决大量研究中都会遇到的样品量和数据量之间的矛盾。再次,较低的检测价格和较少的劳动力投入提高了该技术受使用者欢迎的程度。最后,在同一份样品中检测不同指标可以很好的进行样品内不同指标的内参对照,得到具备独特价值的数据。液相悬浮芯片的不足之处在于灵敏度相对ELISA并无根本突破,而且多指标检测时不同反应相互干扰会带来潜在的数据风险。因此,对于数据要求较高的项目,特别是药物研发等医药研究领域,液相悬浮芯片的弱点常常无法忽视。
新技术展望
虽然现有多项生物标志物检测技术已经丰富了人们对生物标志物的认识,获取了大量数据和经验,解决了很多生物学或医学问题,但如前文所述的诸多瓶颈仍限制了生物标志物的应用。尤其是对于疾病,特别是肿瘤的早期诊断或预防而言,在疾病的潜伏期或是发生早期,就能在血清/血浆这样容易获得且远离病灶的样本中发现生物标志物的存在十分必要。研究表明这些标志物的含量很可能低至每毫升亚皮克级。上述几乎所有的技术对于这一检测区间都显得无能为力。第二,据文献报道,在已知的约400,000种人类蛋白中,有大约75%,也就是300,000种被现有技术很难检测到。大量生物标志物处在现有技术的检测极限之下。第三,现有技术很多情况下受制于较低的灵敏度,仅能在疾病个体中测得某种生物标志物,而此时疾病可能已经进入实际发生阶段。在健康个体或是疾病风险的个体中尽管这些标志物含量极低,但很可能具备预测性作用,而现有技术无法有效利用这一点。第四,医学研究者在临床上获取了各种类型的体液样本,例如脑脊液,宫颈液,肺泡灌洗液,泪液,尿液等,这些体液样本中经常生物标志物含量极低,但却具备特定领域的独特研究价值,而其中蕴含的宝贵生物学信息常被现有技术忽略。因此,人们亟需开发更为灵敏且特异的生物标志物检测技术来更好地满足基础医学或转化医学的研究需要。

图5. 单分子检测技术原理
新技术的诞生为这些研究需求的实现提供了重要的机会。单分子检测技术(Single Molecule Counting, SMC),在抗体依赖的蛋白生物标志物检测方面产生了质的变化。单分子检测主流的检测技术以SMCxPRO等单分子检测平台为代表,其基本原理是SMC系统所产生的激光高能光斑能够最有效地照射和激发单个荧光分子。SMC™单分子检测专利技术会检测区域的单个荧光信号,峰高超过阈值的荧光信号会被统计为数字信号,并将检测到的数字信号进行汇总,显著地提高了检测灵敏度(图5)。这项技术的创始存在一定争议,有多位学者在同一时期利用单分子检测技术对不同分子进行了单分子检测,并取得了成功。其中代表性的工作包括:1996年,Chen等学者成功进行了藻红蛋白的单分子检测;同一年,Craig等学者利用单分子检测技术检测了碱性磷酸酶;1998年,Fister等学者进行了罗丹明6G分子的单分子检测。(参考文献3-5)
针对蛋白生物标志物的检测,单分子免疫检测试剂盒仍采用比较典型的双抗免疫夹心法。与普通ELISA均匀照射96孔板板底的检测方式不同,SMC技术试剂盒会将形成双抗免疫夹心复合物的分子进行解离,然后利用单分子检测方法对荧光素标记的二抗进行测定(图6)。这项技术最大的优势在于灵敏度显著提高,在实际工作中经常能达到每毫升百分之几皮克的灵敏度(图7),大致相当于普通ELISA 1000倍左右的水平。
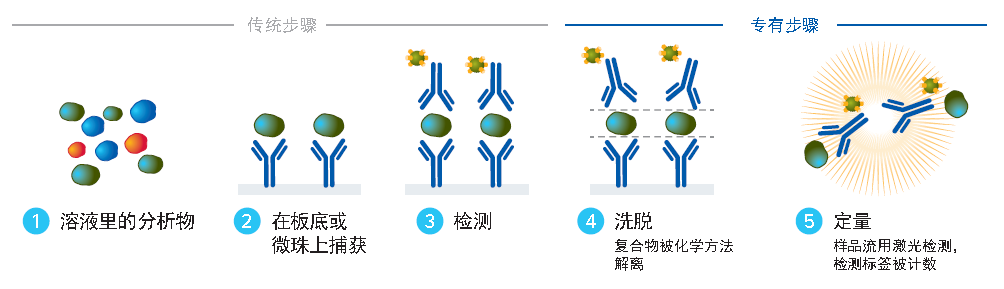 图6. 单分子免疫检测的实验流程
图6. 单分子免疫检测的实验流程

图7. 抗体依赖的生物标志物检测技术灵敏度对比(引自参考文献)
相对于前面所综述的传统检测技术,SMC单分子检测技术的应用正处于高速发展阶段。尽管行业内普遍看好,但这项技术为生物标志物检测带来的变革仍需时间来证明。该技术在肌钙蛋白(Troponin I, cTnI)检测案例中已经展现出非常重要的价值。与传统技术仅能检测心脏疾病个体的cTnI因子不同,这项技术在健康个体中就可测得痕量的cTnI因子。长达12年的研究结果展示了令人惊讶的发现(图8,参考文献6),健康个体的本底cTnI因子与未来心脏病的累积发病率呈反比。在另一项高水平的研究报告中,亨廷顿舞蹈病的未发病个体(突变基因携带者)脑脊液中微量的突变型mHTT蛋白可被稳定测得,为亨廷顿舞蹈病的诊断和治疗提供了全新的方案(参考文献8)。
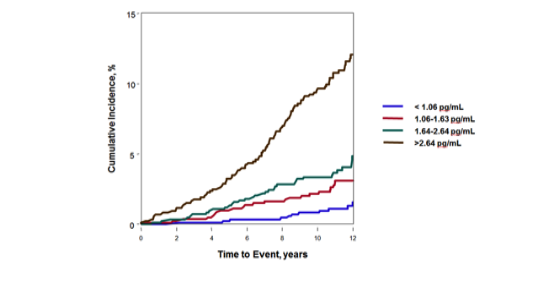
图8. 单分子检测技术对健康个体cTnI的检测可预测心脏病累积发病率
总结
抗体依赖的检测方法毫无疑问是目前最为有效的蛋白生物标志物检测技术。通过数十年的努力,研发人员在灵敏度,多重检测能力和检测特异性方面取得了重要突破,使这类技术产生了长足的进步。以单分子检测技术为代表的超高检测灵敏度,以液相悬浮芯片为代表的多重指标检测技术分别为生物标志物的应用在深度和广度方面进行了延伸。而针对生物体液样本的宽动态范围检测能力使得这些技术在基础、转化医学和临床研究应用开拓了广泛的应用空间。技术的进步决定了生物标志物的应用潜力,生物标志物将为人类健康福祉做出越来越重要的贡献。
参考文献
1 .Coons AH, et al. Proc Soc Exp Biol Med 1941, 47:200–202.
2. Marco LD,et al. Cancer, 2014, 224: 1-10.
3. Chen D,et al.Anal Chem,1996,68(4):690—696.
4. Craig B,et al.Anal Chem,1996,68(4):697—700.
5. Fister C,et al.Anal Chem,1998,70(3):431—437.
6. Wang T,et al. Circulation. 2012, 126: 1596–604
7. Corinne S, et al. Proteomics, 2014, 14: 774-783
8. Edward JW, et al. J Clin Investi, 2015, 1-8


















