应用CTC评估手术疗效及锁定与肿瘤快速复发密切相关的术后CTC亚类细胞,近年来已受到人们的广泛关注。
肝癌是我国高发的恶性肿瘤之一。2015年中国肝癌发病率和死亡率均占据了亚洲所有国家总和的70% (Chen et al., 2016 CA Cancer J Clin 66:115)。手术切除是早期肿瘤治疗的首选方案,然而手术效果对于不同患者而言,差异颇大。以肝癌为例,高达76% 的肝癌患者术后可发生快速复发 (Portolani et al., 2006 Ann Surg 243:229) ,这也是肝癌患者生存期较短的主要原因。
有关CTC在肿瘤转移与复发过程中的重要作用已有很多报道。国外最新的研究发现,不同瘤种的肿瘤患者(如肺癌、乳腺癌、食管癌)手术后仍可检测出CTC,且这些CTCs与肿瘤早期复发的相关性已得到证实(Sandri et al., 2010 Ann Surg Oncol 17:1539;Bayarri-Lara et al., 2016 PloS One 11:e0148659)。然而有关肝癌患者术后CTC与肿瘤快速复发的相关性研究一直处于空白。
最近,由清华大学北京长庚医院肝胆胰外科、病理科、北京大学肿瘤中心(北京肿瘤医院)消化道肿瘤科、解放军301总医院肝胆疾病中心及赛特生物(Cytoingelligen/中国医药城, Cytelligen/USA) 紧密合作,利用赛特SE-i•FISH® 技术平台,在国际上首次成功对肝、胆肿瘤患者手术前后各种CTC亚类细胞(CD31-) 进行动态监测,并锁定了与肝癌快速复发相关的术后CTC亚类细胞。研究发现,大部分(高达67%)肝癌CTC为小细胞 (直径≤5 微米白细胞),患者术后检测出的8号染色体三体小细胞CTC数量 (cut-off: ≥5 CTCs/6 ml 血液)、8号染色体多体EpCAM+循环肿瘤干细胞 (CTSC) 数量和癌栓 (肿瘤细胞团, CTM) 数量 (cut-off: ≥1),均与肝癌患者术后无病生存率(Disease-Free Survival, DFS) 及快速复发密切相关。该研究成果刚刚发表在Cancer Letters杂志上(Wang et al., 2017 Cancer Lett 412:99-107 )。

对于肝癌细胞而言,EpCAM 为干细胞标示物,只表达在少数肿瘤干细胞上 (Terris et al., 2010 J Hepatol 52:280;Munz et al., 2009 Cancer Res 69:5627),而以CellSearch为代表的阳性捕获技术只能偏见性地检出EpCAM 及角蛋白CK双阳性的CTC细胞,因此该技术手段只可对肝癌部分CTC进行检测,且对于其它瘤种的CTC检测也会造成不可忽视的大量假阴性,已远远不能满足人们客观、全面研究CTC的迫切需要。
全新优化的适于检测肝癌等实体瘤CTC的瘤标-i•FISH® 技术
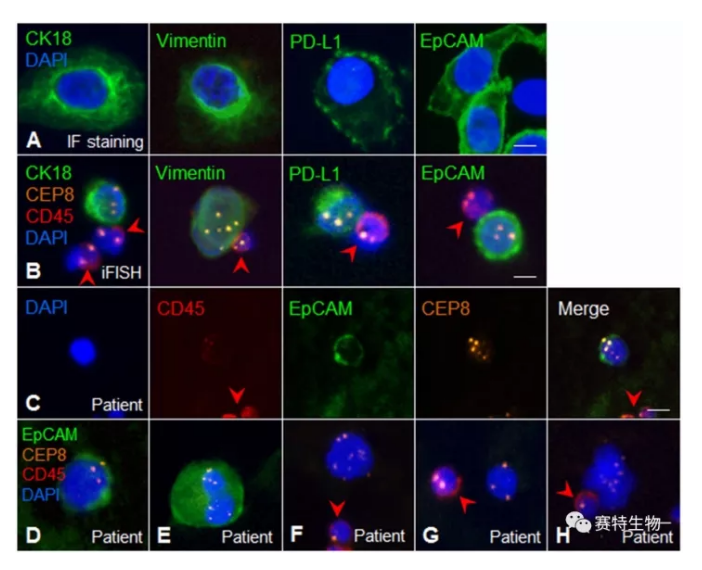
FISH方法是病理科广泛开展的用于检测肿瘤细胞的常规手段。首先,本研究在赛特SE-iFISH技术平台的基础上 (由磊等 2017,临床与实验病理学杂志 33:297; Lin 2015, Clin Transl Med 4:38),针对肝癌等CTC的特点及临床不同需求,进一步优化了EpCAM、PD-L1、Vimentin、CK等多重瘤标iFISH系列检测系统,以达到同步、原位检测肝癌等实体瘤CTC上多重肿瘤标示物蛋白表达与异常染色体的目的。
 血液中非血源性循环异倍体细胞nCAC (non-hematopoietic circulating aneuploid cell)主要由循环肿瘤细胞CTC (CD31-/CD45-) 及异倍体循环血管内皮细胞CEC (CD31+/CD45-)构成 (Lin et al., 2017 Sci Rep 7:9789)。对CTC、CEC进行有效鉴别与区分,是特异性检测CTC的必要前提!
血液中非血源性循环异倍体细胞nCAC (non-hematopoietic circulating aneuploid cell)主要由循环肿瘤细胞CTC (CD31-/CD45-) 及异倍体循环血管内皮细胞CEC (CD31+/CD45-)构成 (Lin et al., 2017 Sci Rep 7:9789)。对CTC、CEC进行有效鉴别与区分,是特异性检测CTC的必要前提!
鉴于肝癌细胞上干细胞标示物EpCAM表达的特殊意义,本研究应用优化的EpCAM-iFISH,并借助Metafer-i•FISH® CTC全自动扫描与分析系统,在有效区分外周血中异倍体CEC (CD31+) 与CTC (CD31-) 的基础上,对肝癌、胆管细胞癌患者手术前、后系统性地进行了CTC检测,并首次发现术后CTC与肿瘤快速复发密切相关。
各CTC亚类细胞在手术前、后的数量变化及比例分布
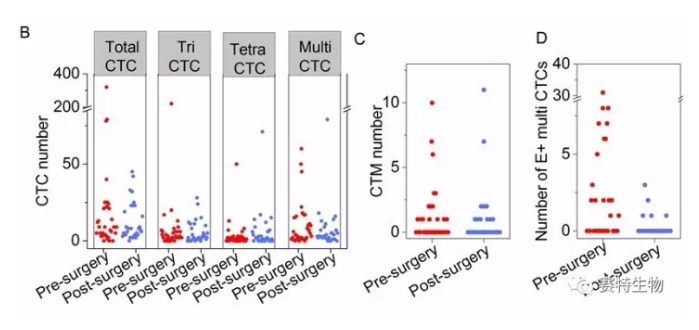
本研究分析统计了各亚类CTC在手术前后CTC总数中的比例分布,其中,EpCAM+ 循环肿瘤干细胞(CTSC) 占总检出CTC的9%。同时,文章对比了手术前后EpCAM+循环肿瘤干细胞、EpCAM- 异倍体CTC及循环肿瘤细胞栓 (CTM) 的数量,结果发现,患者术后除CTSC数目有明显下降外(图D),其余各种CTC亚类细胞及癌栓的数量并没有随着原发肿瘤灶的切除而显著降低。
近年来,有关术后CTC的来源已成为肿瘤界同行日益关注的焦点。除去手术过程本身可能造成肿瘤细胞释放入血外,术后存留的CTC也许并不全都来自于这些切除的实体瘤,一部分可能来源于“早期播散型冬眠肿瘤细胞”(dormant early disseminated cancer cells, eDCCs)。eDCCs在肿瘤形成的初始阶段即已存在于血液或潜伏在不同器官的组织中,它们可能永远处于冬眠状态而不致瘤,也可能被特定因素唤醒、激活,从而造成全身广泛的肿瘤转移(Harper et al., 2016 Nature 540:558; Aguirre-Ghiso et al., 2013 Nat Med 19:276)。需要特别指出的是,8号染色体异常扩增(异倍体)已被证实为是唤醒冬眠肿瘤细胞的主要因素之一 (Hosseini et al., 2016 Nature 540:552)。因此可以合理地认为,本研究检测出的术后肝癌CTC,部分可能属于被唤醒的冬眠肿瘤细胞。
大部分肝、胆肿瘤患者手术前后CTC检出均为阳性,且过半的肝癌患者术后快速复发,有鉴于此,本文对手术前后肝癌CTC及其临床意义进行了深入研究,结果发现肝癌患者术前CTC与病理分期高度相关,而术后CTC数目与肿瘤复发密切相关。
肝癌患者术前染色体三体CTC及癌栓CTM数量与病理及临床分期相关
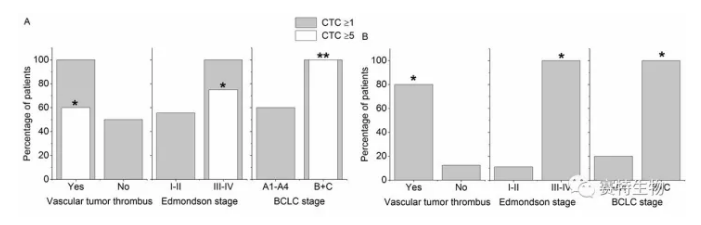
如上图所示,肝癌患者手术前检测出的较高8号染色体三体(trisomy 8) CTC数量 (A, ≥5 CTCs/6 ml 血液)及CTM阳性数量(B, ≥1) 与患者微血管癌栓、病理分期Edmondson stage III-IV、肝癌临床晚期分期 (巴塞罗那BCLC stage B+C) 密切相关。
手术后CTC、CTSC及癌栓CTM数量与肝癌快速复发密切相关
本研究进一步分析了不同亚类CTC与术后肝癌复发的相关性。结果显示,手术后一周患者检出的8号染色体三体CTC数量≥5/6 ml 血液、阳性检出EpCAM+循环肿瘤干细胞CTSC(≥1) 或CTM(≥1),均与肿瘤患者快速复发、较短的无病生存率DFS密切相关。

肝癌小细胞CTC检测的特殊临床意义
肝癌患者手术前后检出的CTC 大部分为小细胞 (≤5 微米白细胞) ,且手术前后小细胞CTC均维持了67%的较高比例,中位数由术前2升为术后4个细胞,而胆管细胞癌(cholangiocarcinoma, CC) 小细胞CTC的比例由术前的53.3%降低为术后的24%,中位数也相应地由7降为5个细胞。
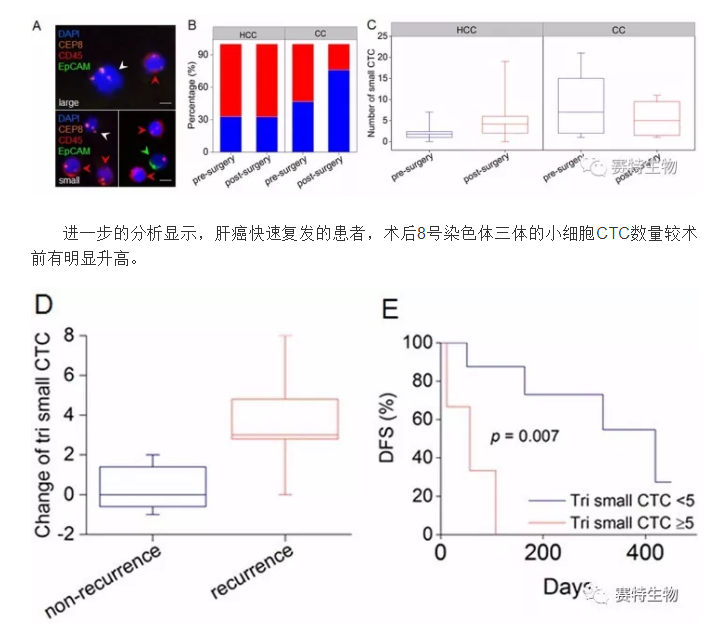
虽然过滤法分离CTC的过程相对简单,但是采用8微米孔径的细胞筛过滤去除5微米白细胞以分离CTC的过程中,不可避免地丢失大量的小细胞CTC (Alunni-Fabbroni et al., 2010 Methods 50:289)。本研究发现大部分肝癌CTC为小细胞,从而合理解释了一直困扰人们的使用细胞过滤法不能有效检测肝癌CTC的问题。
结论
▶ 本研究证实SE-i•FISH®可同步检测肝癌等实体瘤CTC (CD31-) 的异常染色体、及对调控细胞起决定性作用的各种肿瘤蛋白表达,而非检测细胞内“DNA→mRNA→蛋白质”生物链中的过渡性中间产物mRNA
▶ 大部分肝癌患者手术前后均可检测出CTC,但术前与术后CTC具有不同的临床意义,术前CTC数量与肿瘤病理分期及肝癌临床晚期分期高度相关,而术后CTC数量与肝癌快速复发密切相关
▶ 大部分肝癌CTC 为小细胞 (≤ 5 微米白细胞),且手术前后小细胞所占的高比例基本维持不变
▶ 本研究在术后肝癌患者体内首次锁定了与肿瘤快速复发密切相关的CTC亚类细胞,并确定了相应阈值:1) 8号染色体三体小细胞CTC (≥5/6 ml 血液);2) EpCAM+ 循环肿瘤干细胞 CTSC (≥1);3) 循环肿瘤细胞团 CTM (≥1)。此外,术后8号染色体三体小细胞CTC较术前呈增加的变化趋势亦与肝癌快速复发密切相关
本研究及国外的多个临床实验已证实,肝癌等实体瘤患者术后体内存在与肿瘤预后、复发等密切相关的CTC亚类细胞。与检测血浆中不具生物活性的残留核酸片段ctDNA不同,实时监测具有细胞及生物活性的CTC,可为患者手术后进一步开展个体化精准治疗、监测肿瘤复发等提供重要参考依据。


















