肿瘤转移是肿瘤致死的主要原因。患者血液中的循环肿瘤细胞 (CTC) 及病人淋巴结、骨髓 (骨转移)中的播撒肿瘤细胞 (disseminated tumor cell, DTC) 是公认的肿瘤转移与复发的前体细胞。作为液体活检的主要检测指标,CTC、DTC 及其细胞表面表达的各种肿瘤标示物检测,已成为肿瘤治疗的动态靶标。目前,全球共有22个覆盖了多个瘤种的CTC多中心临床实验正在积极开展相关研究,其中涉及了20个CTC肿瘤标示物及14个DTC瘤标。
最近,由上海第一人民医院肿瘤中心、著名的德国Ludwig-Maximillans大学EpCAM 专家Olivier Gires 研究组以及赛特生物 (Cytelligen) 联合发表的综述文章,对肿瘤形成,淋巴、骨及远端器官转移过程中肿瘤细胞的各种变化进行了阐述,并对CTC、DTC 在肿瘤治疗用靶标、评估疗效、指导用药等重要临床意义方面,做了系统性的论述。

肿瘤生成一般是从单细胞基因突变开始。成瘤后,肿瘤组织上的某些特殊肿瘤细胞经过EMT 过程后脱落,并侵润血管。入血的肿瘤细胞 (CTC) 由血液带至远端器官,CTC穿透血管后,经过反向的MET过程,在远端器官形成新的肿瘤转移灶。此过程亦常见于肿瘤复发。
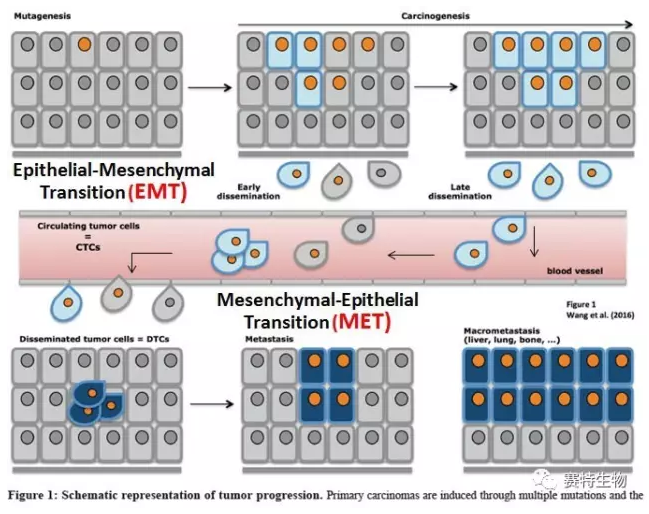
在肿瘤的形成、转移过程中,肿瘤细胞上的各种标示物呈高-低或有-无的动态表达与分布。以EpCAM为例,正常粘膜上皮细胞的EpCAM表达仅限于基底上层细胞,然而成瘤后,肿瘤上皮细胞则开始大量表达EpCAM+,经过EMT过程,入血的CTC呈阴性或阳性与阴性混合型表达(EpCAM- 或 +/-, 角蛋白CK18- 或 +/-)。CTC经MET形成转移灶后,转移灶内的肿瘤细胞又开始表达EpCAM+。
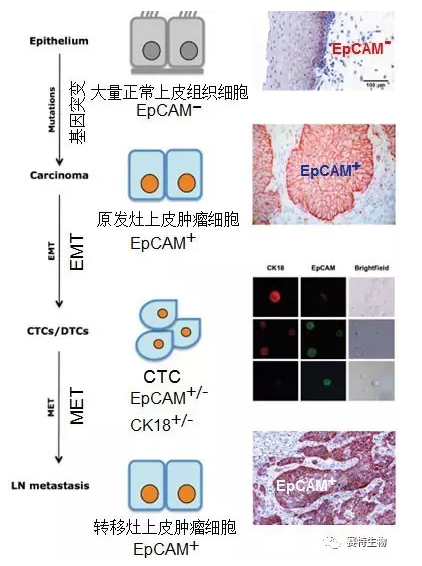
与CTC相比,DTC 不再循环于外周血中,而是定居于远端的骨髓 (骨转移) 或淋巴结,属于比较晚期的肿瘤细胞。由此,DTC包含了更多与肿瘤转移相关的宝贵信息。以食管癌淋巴结转移过程中的DTC为例,本文作者之一的Gires 研究组发现, DTC上的 EpCAM表达变化与病人极差的预后密切相关(Driemel et al., 2014 Oncogene 33:4904)。
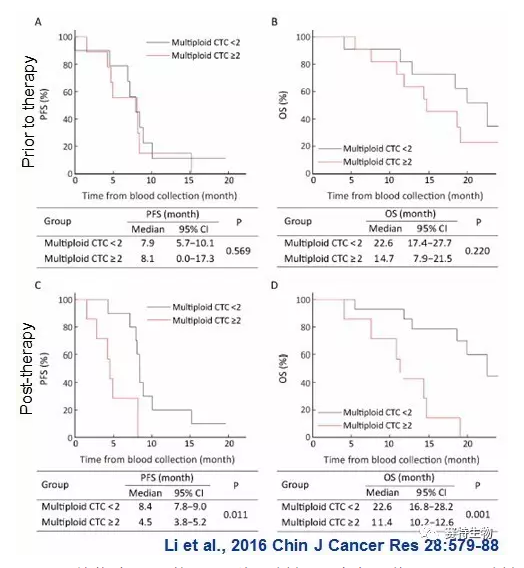
液体活检技术中利用CTC检测来评估肿瘤患者预后已相继被报道。相对于常规的以检测单一肿瘤标示物为基础的简单CTC计数,我们与北京大学肿瘤中心 (北京肿瘤医院) 沈琳主任课题组联合,针对染色体异倍体CTC及其临床意义进行了深入研究。已发表的文章结果显示,胃癌病人体内8号染色体多倍体 (≥5) 与三倍体CTC对化疗药物顺铂具有不同的内源性或继发性耐药特性 (Li et al., 2014 Oncotarget 5:6594-6602)。此外,我们最新联合发表的临床研究证实,胃癌病人两程化疗后体内残存的多倍体CTC数目,与病人的肿瘤无进展生存期 (PFS) 及总生存期 (OS) 高度密切相关(Li et al., 2017 Chin J Cancer Res 28:579-88)。
目前临床上共使用28种抑制剂抗肿瘤药物,这些抑制剂主要针对肿瘤进展病人体内的原发实体瘤细胞上的常见抗原(如HER2, EGFR, EpCAM, VEGF, BRAF等)发挥作用。最近,人们已开始根据CTC/DTC检测结果对早期乳腺癌病人开展相关治疗(Tolaney et al., 2015 N Engl J Med 372:134)。
不同于以往的TNM分期,一种针对CTC/DTC进行“分子分期”(molecular staging) 的新概念已被提出并付诸实践。检测CTC/DTC中的核酸及各种肿瘤标示物的表达,势必会为包括辅助治疗 (adjuvant therapy) 在内的肿瘤精准治疗提供更加可靠的依据。相关实例比比皆是,如乳腺癌病人体内间质化 (Vimentin+) CTC数目的增多,与肿瘤进展及耐药密切相关;前列腺肿瘤病人CTC 上的雄激素受体 (AR) 的表达可以为二线抑制剂治疗提供判断标准等等。EpCAM和CK的蛋白表达与一系列肿瘤的分化、转移、预后及复发的密切相关性之前已详细讨论 (Lin, 2015 Clin Transl Med 4:38; 由磊等,2017临床与实验病理学杂志 33:297)。
目前全球共有22个多瘤种、多中心的CTC临床实验正在积极开展中,这些工作已不再局限于简单的CTC计数,而是针对CTC上的 20个相关瘤标及DTC上的14个瘤标 (包括EpCAM, HER2, Vimentin, CD133, CD44 等) 进行新药的设计开发与临床疗效评估。此外,在肿瘤细胞上进行PD-L1检测已是相关免疫治疗选择的前提。
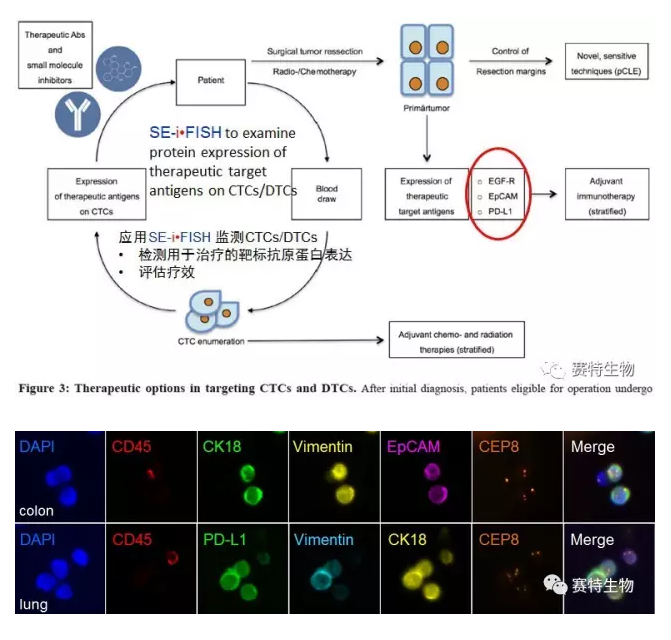
赛特生物(Cytointelligen China, Cytelligen USA) 开发的独特SE-iFISH CTC检测系列技术产品,与蔡司Metafer-i•FISH全自动CTC图像扫描分析系统相结合,可在肿瘤细胞上原位进行染色体分析、多个瘤标的蛋白表达检测分析及不同亚类CTC/DTC 的自动数理统计。该整合技术平台在目前进行的多个CTC/DTC 临床实验中显现出了一系列技术优势,如在观测肿瘤细胞EMT状态 (EpCAM, CK/Vimentin) 的基础上,对CTC/DTC的其它瘤标 (如HER2, PD-L1, CA19-9, CEA等) 及染色体的不同倍体数目进行同步检测,用于CTC亚类分型、肿瘤细胞分子分型、指导临床用药、疗效及预后评估、肿瘤耐药与复发的实时监测等,并为抗肿瘤新药靶点的发掘、肿瘤单细胞测序等方面奠定了坚实基础。















