2012年,Jennifer Doudna与其同事合作发表了题为“A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity”的论文,一种名为“CRISPR/Cas9”的DNA编辑技术横空出世(陈老湿讲故事(第六弹)--生物膜干涉技术在基因编辑技术CRISPR/Cas9中的应用),作为CRISPR技术的先驱,Jennifer教授在学术和商业上的成就有目共睹。每年,她带领的团队都会在CNS等顶级期刊上发表多项成果。据Jennifer实验室官网显示,2016年,研究小组已经在Cell、Nature、Science、Nature Biotechnology、Nature Methods等杂志上发表了二十几遍论文,可谓高产。时至今日这种技术已经风靡全球。

自2012年以来,研究人员利用CRISPR的强大“基因组编辑”技术对生物的DNA序列进行修剪、切断、替换或添加。他们利用CRISPR剪断和取代不需要的DNA,来开发治疗癌症、HIV、失明、慢性疼痛、肌肉萎缩症和亨廷顿症等疾病的疗法。虽然基于CRISPR的治疗方案还需要数年时间才能在人体上进行测试,但几乎每天都有无数出版物介绍利用这种新工具在人类健康和人类遗传学方面的新发现。凭借操作简单,效率高和成本低,CRISPR/Cas9系统是目前基因编辑的最热门的工具之一。但是,(陈老湿敲了敲黑板)Nature Methods杂志上题为“Unexpected mutations after CRISPR-Cas9 editing in vivo”的研究轰动了整个科研圈,通过全基因组测序分析表明,CRISPR基因编辑会引入数百种不可预估的突变到基因组中,引发了大家关于CRISPR系统潜在脱靶效应的热烈讨论。脱靶问题已经严重限制了CRISPR在生命科学和医学领域的应用。
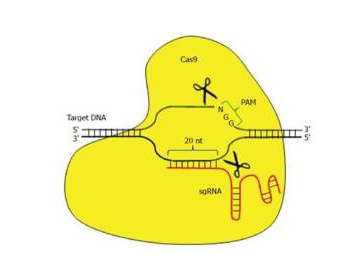
最近,女神发表在Science Advances期刊上,标题为“Disabling Cas9 by an anti-CRISPR DNA mimic”的论文。让CRISPR-Cas9分子利用向导RNA(gRNA)发现、切割和替换导致镰状细胞疾病的血红蛋白编码基因突变体。他们证实了一种被称作AcrIIA4的特定抗CRISPR蛋白将这种CRISPR-Cas9分子的脱靶效应降低4倍。它在做到这一点的同时不会显著地降低预期的在靶基因上编辑。且看下面陈老湿给大家的讲解。
分子筛和电泳的结果显示只有在sgRNA存在的情况下AcrIIA4才能与SpyCas结合。采用冷冻电子显微镜深入探索AcrIIA4的作用机制。发现AcrIIA4蛋白是通过竞争绑定到通常是用来结合DNA的Cas9酶上“凹陷袋”结构域来发挥作用的,从而阻断Cas9酶与DNA的相互作用。如下图所示:
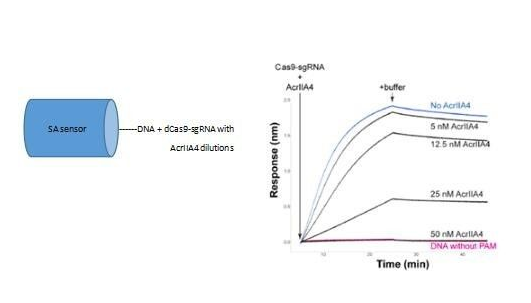
作者通过琼脂糖凝胶电泳实验发现AcrIIA4有效保护靶点DNA不被CRIPSR-Cas复合物剪切,这意味着AcrIIA4可能成为Cas9的“停止开关”。为了进一步掌握AcrIIA4的作用机制,作者通过生物膜干涉技术研究了AcrIIA4对dCas9-sgRNA与靶标DNA的结合与解离的影响,首先将生物素化的靶点DNA固化在链霉亲和素传感器上,与混入了不同浓度的AcrIIA4的dCas9-sgRNA复合物结合,发现混入的AcrIIA4浓度越高,dCas9-sgRNA结合信号越小,说明AcrIIA4会抑制靶点DNA和dCas9-sgRNA的结合。如下图所示:
然后用生物膜干涉技术又做了一个实验,就是在结合dCas9-sgRNA后,在解离的时候加入AcrIIA4,发现AcrIIA4对靶标DNA的解离无影响,通过BLI技术对AcrIIA4的作用机理也研究的更加透彻了。

最后作者在K562白血病细胞内引入了一个针对2个基因(其中包括与镰状细胞病有关的基因)进行剪切的CRISPR-Cas9复合物,6小时后添加了AcrIIA4。结果显示,在恰当的时间添加AcrIIA4可防止在错误的位置剪切基因,同时CRISPR也仍有时间在正确的位置进行基因剪切。
CRISPR-Cas9强大的基因编辑的能力是一把锋利的双刃剑。无法想象,如果你坐在没有刹车的汽车上!从临床应用的角度的来看,能够精确地控制在何时和在何处进行基因编辑是至关重要的。现在这些抗CRISPR蛋白为完全关闭Cas9和微调它的活性提供了机会。
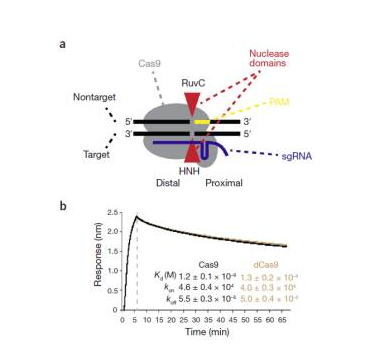
该实验室也运用生物膜干涉技术对CRISPR-Cas9技术做出重大改进,结果发表在(Nature Biotechnology,这个影响因子逆天的杂志就不多说了,韩某某就是在这个杂志发文章而名声大噪)。作者通过生物膜干涉技术发现Cas9在完成了对双联DNA切割的长达6个小时内仍然附着在染色体上,这个与生物膜干涉技术得出的解离常数非常复合。
以此为切入点,作者还发现这一蛋白紧紧抓住了三个切口端,而有一个切口端不受牵制。将替代DNA模板直接带到切割位点,将会提高修复效率。他构建出了一个DNA片段,其与自由的DNA端相匹配,并携带着将插入到另一端中去的遗传序列,使得突变的修复成功率达到了60%。这一改进的技术在试图去修复导致遗传性疾病,如镰状细胞病或严重联合免疫缺陷的遗传突变之时尤其有用。gRNA/Cas9复合物和靶点DNA的高亲和力是CRISPR/Cas9的剪切高效率的必要条件。
不得不说CRISPR/Cas9已经成为基因组编辑的神剪,而BLI技术就是这款技术的磨刀石,可以让CRISPR/Cas9神剪越磨越锋利。
文献来源:
Disabling Cas9 by an anti-CRISPR DNA mimic.Science Advances,doi:e1701620,2017.
Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA.NATURE BIOTECHNOLOGY VOLUME 34 NUMBER 3 MARCH 2016

















