近年来有关CTC的基础与临床研究发展迅速。赛特生物凭借多年在CTC研究领域的影响力,应“诊断学”(Diagnostics, MDPI Publisher)杂志的邀请,将iFISH应用于CTC 与CEC的诊断与研究的最新进展进行了汇总,刚刚发表在Diagnostics的特别专刊“CTCs as Cancer Diagnostic Biomarkers”上[Lin2018, Diagnostics (Basel, Switzerland) 8:26 (1-13)]。本特刊的特邀编辑Dr. Dario Marchetti教授,任职于美国著名Baylor 医学院,并担任著名的休斯顿Methodist 医学中心Biomarker研究部的主任,是国际知名的CTC专家,在Nature Medicine, Science Translational Medicine 等一流杂志上发表过多篇论著。

本文章有关iFISH检测CTC的最新进展及关键点如下:
-
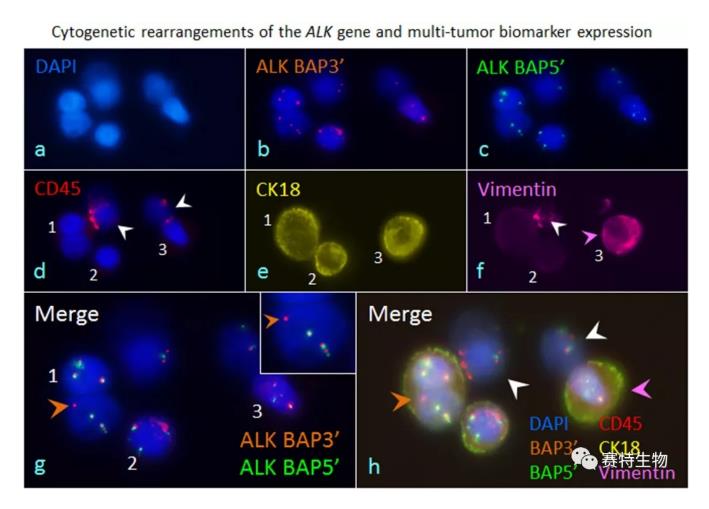
iFISH同步原位检测肿瘤细胞染色体上的基因重组 (非小细胞肺腺癌ALK融合基因)、染色体异倍体及多重瘤标表达 (PD-L1, HER2, Vimentin...)
-
系统性介绍染色体异倍体CTC及循环血管内皮细胞CEC
-
异倍体CTC及CEC的单细胞挑取、单细胞全基因组扩增及单细胞NGS二代测序
-
锁定了不同瘤种、不同iFISH CTC的单细胞具有相同的单核苷酸突变基因 (SNV) :TP53
-
锁定了不同瘤种、不同iFISH异倍体CEC (CD31+ )的单细胞具有相同的单核苷酸突变基因: CDKN2A
-
整体考量细胞生物链三要素(核酸、蛋白、细胞形态)是建立有效检测CTC整合方法的基础
不同于常规的肿瘤组织病理学的一次性检测,持续监测CTC瘤标表型、染色体异倍体核型及染色体基因重组动态变化的特殊临床意义
肿瘤细胞的染色体异常
在刚刚结束的美国AACR肿瘤研究大会上,有关肿瘤细胞(包括CTC)染色体异常的研究成为本次会议的热点之一,受到人们的密切关注。肿瘤细胞染色体异常表现为异倍体(包括缺失、扩增)或染色体基因重组 (rearrangements)。
染色体异倍体分为 constitutional (体质性/或天生性)及somatic (体细胞)异倍体两种类型。前者源自生殖细胞减数分裂时期因染色体分离不当,而导致全身所有不同器官的细胞均具有异倍体的特性;而后者“体细胞异倍体”则来自某些细胞的有丝分裂偏差,形成整条染色体或某条染色体大片段的异倍体性状,是肿瘤细胞最常见的特征,与肿瘤的发生、发展密不可分。异倍体可导致细胞基因组的不稳定性,影响几百种基因的表达,进而产生显著的表型变化,并导致肿瘤细胞的高异质性、耐药以及治疗无效。目前临床上已有针对染色体异倍体的肿瘤治疗药被成功开发出来。
染色体异倍体作为肿瘤细胞的标志性特征 (Gordon et al., 2012 Nat Rev Genet 13:189; Kops et al., 2005 Nat Rev Cancer 5:773),其不仅广泛存在于实体肿瘤、血液肿瘤的细胞中,同时也存在于CTC、肿瘤组织血管内皮细胞 (endothelial cell,EC) (Hida et al., 2004 Cancer Res 64:8249) 及循环血管内皮细胞 (CEC) 中(Lin et al., 2017 Sci Rep 7:9789)。
染色体基因重组常见于非小细胞肺腺癌细胞内,位于2号染色体上的EML4(p21)与断裂的ALK(p23)倒位融合,形成新的肺腺癌驱动融合基因(EML4-ALK,ALK阳性),致使ALK激酶活化,再通过一系列细胞内信号传导通路,使得细胞的增殖和生长不受控制,从而导致肿瘤的发生。目前临床上主要使用络氨酸激酶抑制剂 (ALK-TKI) 对ALK融合基因阳性的非小细胞肺癌进行靶向治疗。ALK完整基因的断裂是形成ALK融合基因的首要前提,而ALK断裂的主要判别方法之一,是应用美国雅培公司生产的诊断级别的DNA探针进行FISH检测。
SE-i•FISH 有效检测与分型各种CTC及CEC
目前各种CTC鉴别方法基本上都是以细胞生物链三要素“核酸”、“蛋白”、“细胞形态”中的单一要素进行考量,比如基于细胞核酸层面的FISH、PCR、RNAish等方法,基于细胞蛋白层面的免疫荧光染色方法以及基于细胞形态的检测(细胞大小和细胞团)。
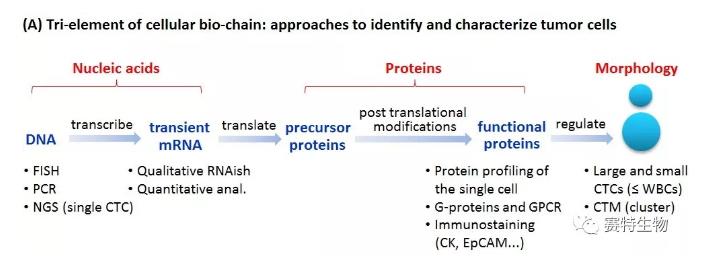
但若要建立完善的CTC技术平台以有效检测广谱的(full spectrum)CTC,需要统筹兼顾CTC的“富集 (SE)”与“鉴别 (iFISH)”两大关键环节,并整体考量细胞生物链三要素。肿瘤细胞内细胞生物链的起始物质DNA最为稳定且最具代表性,其编码的最终产物蛋白质则最为关键。肿瘤蛋白决定了肿瘤细胞一系列表型的异质性,与肿瘤的发生、发展、疗效、预后及复发密切相关。不同形态的CTC (如小细胞CTC、癌栓CTM等)均有重要的临床意义,尤其是使用过滤法漏掉的比白细胞小或与白细胞近似的小细胞CTC与肿瘤复发有着密切的相关性(Wang et al., 2018 Cancer Lett 412:99)。有鉴于此,SE-iFISH重点兼顾了DNA、蛋白表达及细胞形态三要素。而mRNA检测,因其受转录与翻译的多重调节,是细胞内不稳定的中间过渡性产物 (transient),大多被用于锦上添花的细胞功能性观察,所以没有列入SE-iFISH的考量之中。
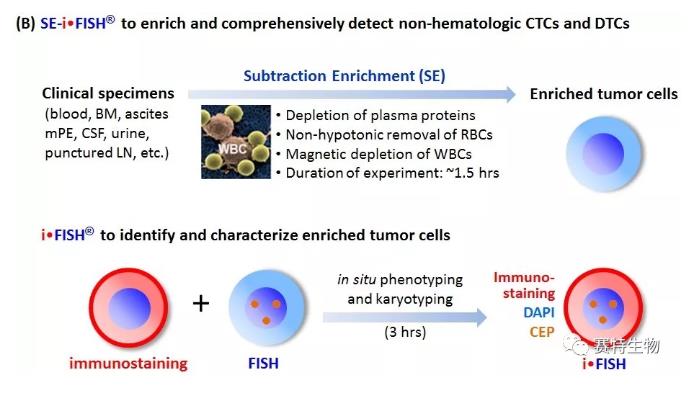
“差相富集 (SE)”通过有效去除白细胞及非溶破法去除红细胞而达到有效富集CTC的目的。富集得到的CTC具有高度活性,可适于肿瘤细胞原代培养及各种后续检测。“iFISH”则是将肿瘤蛋白的免疫荧光染色 (PD-L1, HER2, Vimentin...)与检测染色体异倍体的FISH相结合,在高灵敏、高特异检测CTC的基础上,根据瘤标表达及染色体倍体的不同,可对CTC进行亚类分型。SE-iFISH大量文献证据显示,在肿瘤病人或PDX肿瘤动物模型中检测出的不同亚类的CTC,在肿瘤耐药、转移、复发等方面具有不同的临床意义。
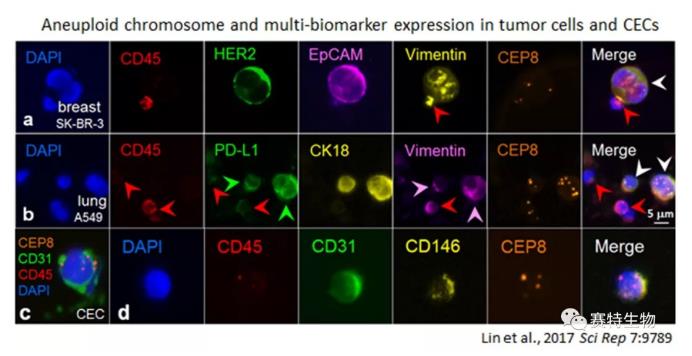
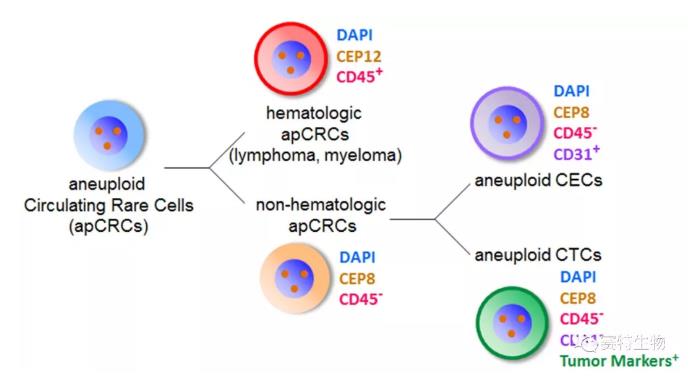
我们对血液中CD45染色阴性、非血源性异倍体的循环稀有细胞apCRC 做了进一步深入研究,发现apCRC 可以分为血源性apCRC (CD45+, hematologic) (代表性细胞为淋巴瘤、骨髓瘤细胞)及非血源性apCRC (CD45-, non-hematologic),后者主要由异倍体CTC与异倍体CEC (CD31+)组成(Lin et al., 2017 Sci Rep 7:9789)。对CTC与CEC这两类不同细胞的有效区分,可以避免异倍体CEC对CTC检测造成致命的假阳性干扰。
iFISH除了对CTC的染色体倍体进行有效检测,还可在检测多种肿瘤标示物的基础上,同时对肿瘤细胞及CTC内的染色体基因重组 (如非小细胞肺癌ALK融合基因)进行有效检测。使用雅培ALK FISH探针进行iFISH检测,清晰可见与EML4基因融合的ALK断裂基因阳性信号 (橙色箭头)。
CTC、CEC 单细胞全基因组扩增及单细胞NGS 测序
利用赛特生物特殊的非激光单细胞分离系统 (non-laser microscopic single cell manipulator, NMSCM),可挑取具有不同临床意义的iFISHedCTC或CEC亚类单细胞。我们已与合作单位成功进行了单细胞全基因组扩增及二代测序。
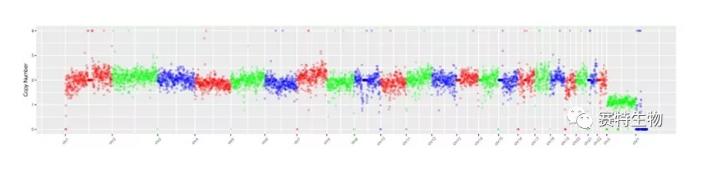
初步的单细胞基因检测结果显示,不同瘤种的肿瘤病人(肺癌、胰腺癌、乳腺癌) 体内的不同CTCs 具有共同的TP53单核苷酸基因突变 (non-synonymous SNV);而这些病人体内不同的异倍体CECs 则具有共同的CDKN2A单核苷酸基因突变。
TP53与CDKN2A均为抑癌基因 (tumor suppressor gene),分别编码产生抑癌蛋白p53、p14及p16。其中,CDKN2A编码的p14 蛋白具有保护p53的作用,而p16对细胞的分裂周期具有调控作用。因基因突变而导致特殊位点的氨基酸置换会引起相关抑癌蛋白失活,进而在肿瘤的发生及生长过程中起着非常重要的作用,如我们已发现的p53(P33R)。
异倍体CTC与CEC具有不同的特征性 (symbolic) 单核苷酸基因突变,这也再次证明这是两类完全不同的细胞,在CTC检测过程中绝不能将两类细胞混为一谈!
持续监测肿瘤细胞各种生物学性状的动态变化
肿瘤患者体内的原代肿瘤细胞异质性极高。伴随着肿瘤不断进展及各种治疗手段的应用,肿瘤细胞上无论是适于靶向药物治疗的靶点蛋白表达 (如HER2等),还是药敏/耐药基因 (如非小细胞肺癌NSCLC靶向药易瑞沙L858R/T790M)、融合基因 (如NSCLC 腺癌ALK基因)等,这些蛋白表型和基因突变也始终处于动态的阴-阳转化过程中。在刚刚举行的美国AACR 2018 大会上,肿瘤细胞的多种基因突变随着治疗进程而逐渐由阴向阳转变也是会议关注的重点。
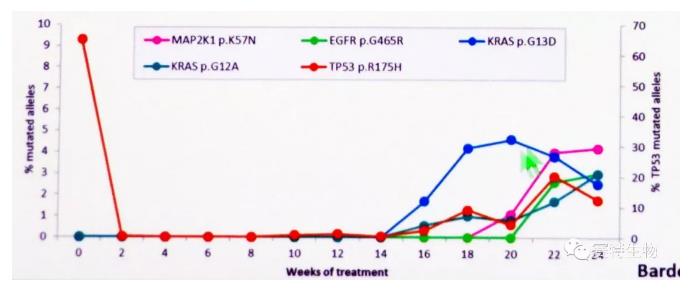
人们已经认识到,常规单次检测的肿瘤标示物蛋白表达或各种基因突变的结果,不足以有效覆盖、反映肿瘤持续的动态变化。对于适于靶向治疗的病人而言,单次某项靶点检测的阴性,不意味该靶点持续阴性,而是应利用液体活检技术持续监测肿瘤细胞(如外周血CTC、骨髓DTC) 各种生物学性状的动态变化,从而为肿瘤患者的精准治疗提供准确而全面的客观依据。
结论
随着SE-iFISH、单细胞蛋白组学 (Sinkala, et al., 2017 Nat Commun 8:14622)、单细胞基因组学等技术的不断成熟,人们对异倍体CTC与CEC的了解也会不断加深。一系列重要的问题有待深入研究,如突变的TP53与CDKN2A基因是否可驱动、促进CTC及CEC 进入血循环?动态CEC是否为CTC形成转移灶提供微环境 (两类细胞融合成团的现象已有报道,Lin et al., 2017 Sci Rep 7:9789)等。对于这些问题的解答可以帮助人们进一步了解、阐明CTC与CEC在肿瘤血管生成 (angiogenesis)、肿瘤的发生、发展、转移等过程中是如何相互协同及相互作用的 (cross-talk and functionally inter-play),从而为肿瘤的防治研究提供有力的支持!


















